Трансфер на енергија со флуоресцентна резонанца (FRET)
Трансфер на енергија со флуоресцентна резонанца (FRET) е процес на нерадијативен пренос на енергија во кој енергијата на возбудената состојба на донаторот се пренесува во возбудената состојба на акцепторот преку интеракцијата на интермолекуларните електрични парови.Овој процес не вклучува фотони и затоа не е радијативен.Оваа анализа ги има предностите што е брза, чувствителна и едноставна.
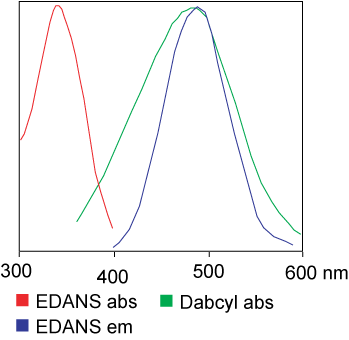
Бојата што се користи во анализата FRET може да биде идентична.Но, во повеќето апликации, всушност се користат различни бои.Накратко, преносот на енергијата на светлечката резонанца е пренос на пар диполи од донорот (боја 1) до акцепторот (боја 2) кога донаторската група е возбудена.Општо земено, емисиониот спектар на донаторската флуорофор група се преклопува со спектарот на апсорпција на групата Акцептор.„Кога растојанието помеѓу двата флуорофора е соодветно (10-100 А), може да се набљудува преносот на енергијата на флуорофорот од донаторот до примачот.Начинот на пренос на енергија зависи од хемиската структура на рецепторот:
1. Се претвора во молекуларна вибрација, односно исчезнува прозрачната светлина на пренос на енергија.(Рецепторот е средство за гаснење на светлина)
2. Емисијата е поинтензивна од самиот рецептор, што резултира со поместување на црвено во секундарниот флуоресцентен спектар“.(Рецепторите се светлечки емитери).
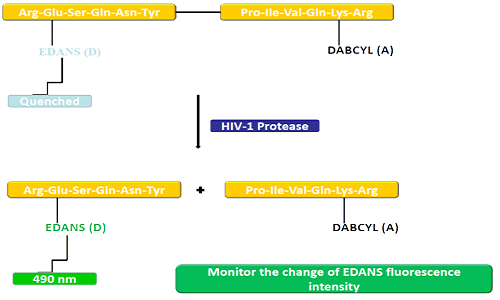
Донаторската група (EDANS) и генот акцептор (DABCYL) се рамномерно поврзани со природниот супстрат на ХИВ протеазата, а кога супстратот не е исклучен, DABCYL може да го угаси EDANS и потоа да стане неоткрилив за флуор.По исклучувањето на ХИВ-1 протеазата, EDANS повеќе не се гаси со DABCYL, а EDANS луциферазата последователно може да се открие.Достапноста на инхибитори на протеаза може да се следи со промени во интензитетот на флуоресценција на EDANS.
FRET пептидите се погодни алатки за проучување на неспецифичноста на пептидазата.Бидејќи неговиот процес на реакција може постојано да се следи, тој обезбедува пригоден метод за откривање на ензимската активност.Сјајот произведен по хидролизата на пептидните врски од донаторот/акцепторот обезбедува мерка за ензимската активност при наномоларни концентрации.Кога пептидот FRET е недопрен, тој покажува ненадејно исчезнување на внатрешниот блиц, но кога некоја пептидна врска спроти донаторот/прифаќачот ќе се прекине, тој ослободува блесок, кој може да се детектира континуирано и потоа може да се квантифицира ензимската активност.
Време на објавување: 14-ти август 2023 година